Полученные в ходе экспериментов аминокислоты представляют собой мономеры для пептидов и протеинов. Пока еще не удалось экспериментально показать (не имеется пока и убедительных моделей), каким образом можно изолировать аминокислоты от остаточных побочных продуктов, очистить их и собрать в нужной для дальнейших реакций концентрации. В результате реакции конденсации две аминокислоты конденсируются в дипептид, при этом на одно соединение пептида освобождается одна молекула воды (рис. 5.5).
В этом случае химическое равновесие находится на стороне отдельных аминокислот, поэтому необходимая для образования протеина реакция поликонденсации происходит в водном растворе только при строго определенных условиях (активированные аминокислоты или протеиновый катализ), которых нет в условиях "бульона".
Процессы гидролиза, посредством которых расщеплялись соединения, не стоит недооценивать: для полипептидов в водной среде эта реакция вполне конкурентоспособна по сравнению с синтезом. Поэтому способные функционировать макромолекулы, в случае их возникновения в "бульоне", не могли бы долго существовать. Кроме того, образование полипептидов становится возможным лишь тогда, когда карбоксилы и аминогруппы аминокислот активизируются, а боковые цепочки защищаются от воздействия нежелательных побочных реакций, как это происходит в живой клетке. Для образования цепочки без разветвления (наряду с этой предпосылкой) необходимы в качестве исходных соединений, по крайней мере, так называемые бифункциональные молекулы (молекулы с двумя активными центрами); монофункциональные молекулы не способствуют росту цепочки. Химик, специалист по полимерам из Карлсруэ Б. воллмерт со всей ясностью указал на то, что в присутствии монофункциональных соединений (даже если они присутствуют только в следах) возникают лишь короткие цепочки. Даже некоторое неравномерное соотношение бифункциональных соединений (переизбыток компонента) все равно неизбежно ведет к образованию коротких цепочек (рис. 5.6).Для получения длинных полимерных цепочек необходимо работать с очень чистыми бифункциональными соединениями, взятыми в точно определенных соотношениях, что, однако, для всех до настоящего времени известных попыток моделирования "бульона" является абсолютно нереальным.
В теоретических моделях были приняты во внимание даже реакции на границе раздела фаз и реакции на жесткой поверхности (гетерогенный катализ) для поликонденсации в "бульоне". Однако ссылка на то, что эти процессы могли играть существенную роль, недоказуема.
Происхождение протеиноидов
Более длинные аминокислотные цепочки (полипептиды) до сегодняшнего дня не были синтезированы в водном "бульонном" растворе.
Фоке мог получать при нагревании до 70 - 200°С чистых и сухих аминокислотных смесей (смеси без воды) полимеры аминокислот, которые получили название протеиноидов. При этом, однако, такие аминокислоты, как цистеин, серии и треонин большей частью разрушились. Кроме того, в ходе этих синтезов наступают реакции и в боковых цепочках, которые приводят к "сшиванию" макромолекул в сетчатый полимер, к образованию мостиков между макромолекулами (рис. 5.7).
Подобные обладающие полимерной сеткой аминокислотные полимеры не могут быть вовлечены в процесс передачи информации, который мы знаем по взаимодействию протеинов, ферментов, ДНК и, соответственно, РНК. В биологических системах информация кодируется линейно, то есть при помощи последовательности отдельных мономерных звеньев, и только так может быть передана (см. рис. 4.1). Заключение: исходное условие, согласно которому в ранний период развития Земли существовали чистые аминокислотные смеси, абсолютно нереально.
Некоторые произведенные таким образом полимеры аминокислот были исследованы на предмет их каталитического воздействия относительно основных биохимических реакций - гидролиза, декарбоксилирования, трансаминирования, окислительно-восстановительных реакций и т. д. (рис. 5.14).
Они имели огромное значение для возникновения первых процессов обмена веществ. Специфичность субстрата протеиноидов чрезвычайно мала, а достигнутое повышение скорости реакции далеко от того, что известно о биологически активных ферментах. Неспецифический катализ - это процесс, который не стоит упоминания, он может происходить в реакционных растворах даже при воздействии загрязнений, например, в присутствии следов металла. Полученные посредством неконтролируемой полимеризации протеиноиды, вероятнее всего, не имеют значения для возникновения жизни.
Рис. 5.6. Для наглядного изображения возникновения макромолекул путем поликонденсации могут служить шарики с кнопочками ("положительные" и "отрицательные"), как это было предложено воллмертом. На рисунках А и В изображены два различных возможных варианта возникновения цепочки молекул путем поликонденсации. ДНЯ ('соответственно А) и протеины (соответственно В) являются молекулами цепочки, образующейся таким способом (поликонденсация бифункциональных молекул). В условиях "бульона" большая часть соединений - это монофункциональные молекулы (С). Кроме того, различные виды молекул находятся не в равном соотношении друг с другом (см. рис. 5.4). Оба варианта, взятые каждый в отдельности, препятствуют возникновению длинных цепочек молекул. Поэтому в "первозданном бульоне не могут возникнуть необходимые для живых существ макромолекулы, ведь нельзя ожидать там появления механизмов, посредством которых можно предотвратить обрыв цепочек. Дальнейшие пояснения в тексте. (По vollmert, 1983 и 1985.)
Рис. 5.7. Более половины аминокислот, наиболее часто встречающихся в современных протеинах, занимают третье активированное положение (стрелки на рис. А) внутри молекулы (А - би- или трифункциональные аминокислоты), так что в протеиноидах возникают не только соединения пептидов (обозначенные жирной линией связи), но и мостики между макромолекулами (стрелки на рис. В). В этом заключается основное отличие от сегодняшних протеинов. Поэтому протеиноиды не могут кодироваться генетически простым способом.
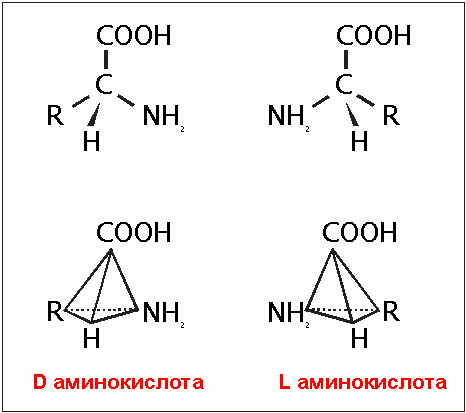
Рис. 5.8. L- и D-аминокислоты. Обе формы являются зеркальным отражением, друг друга. Все аминокислоты имеют одинаковую структуру основания и отличаются лишь R-радикалом, см. рис. 6.8. В экспериментах по воссозданию "бульона" всегда присутствуют обе формы.